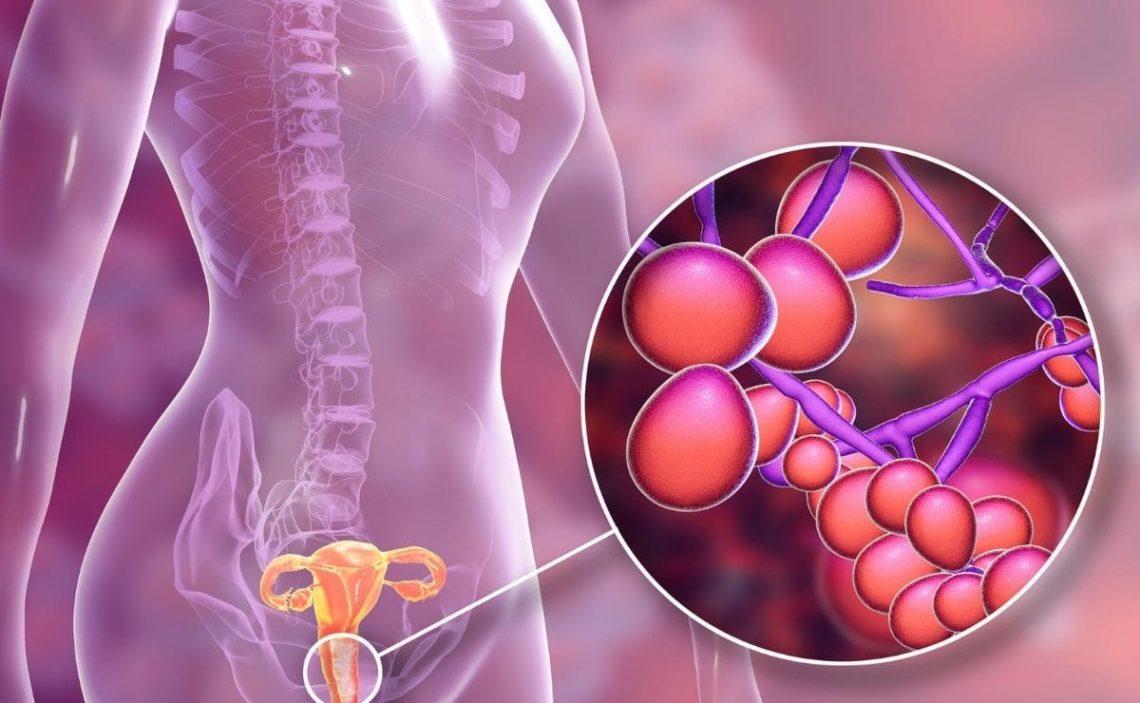
La candidiasis vulvovaginal se define como una vaginitis sintomática (inflamación de la vagina), que a menudo afecta a la vulva (eritema e hinchazón), causada por una infección con una levadura Candida (1).
El síntoma predominante es el prurito vulvar. También puede haber flujo vaginal anormal (material ‘similar al queso’ o una secreción acuosa). El ardor, el dolor y la irritación vulvar también son síntomas comunes, y estos pueden estar acompañados de disuria o dispareunia, que empeoran durante la semana anterior a la menstruación. El desarrollo de candidiasis vulvovaginal sintomática probablemente representa un mayor crecimiento de hongos que antes colonizaban la vagina sin causar síntomas (1).
Los factores de riesgo para la candidiasis vulvovaginal incluyen embarazo y otras situaciones que aumentan los niveles de estrógeno (p. ej., uso de anticonceptivos y terapia con estrógeno), diabetes mellitus, inmunosupresión, antibióticos sistémicos, actividad sexual frecuente y sucia, diafragmas, espermicidas, dispositivos intrauterinos y las duchas vaginales se consideran factores de riesgo importantes. La incidencia de candidiasis vulvovaginal aumenta con el inicio de la actividad sexual, pero no encontramos evidencia directa de que la candidiasis vulvovaginal se transmita sexualmente (1,2).
Los cinco lactobacilos más comunes en el nicho vaginal (Lactobacillus crispatus , Lactobacillus iners , Lactobacillus gasseri , Lactobacillus jensenii y Lactobacillus vaginalis ). La dominación de L. crispatus es más eficaz para mantener a raya a los anaerobios asociados con la vaginosis bacteriana (VB). La VB es la disbiosis vaginal bacteriana más común y generalmente se caracteriza por una comunidad muy diversa de anaerobios, incluida Gardnerella vaginalis , pero a veces por dominancia de G. vaginalis. Casi todos los casos de disbiosis vaginal fúngica son causados por Candidaespecies, predominantemente Candida albicans (2).
En las revisiones sistemáticas (2-4) revisadas, están de acuerdo de que el uso de lactobacilos exógenos (probióticos o productos bioterapéuticos vivos) optimiza la composición de la microbiota vaginal (VMB) como parte de las intervenciones curativas o preventivas de disbiosis vaginal.
Mientras que el tratamiento antibiótico de la vaginosis bacteriana (con metronidazol oral o vaginal o clindamicina) y el tratamiento antimicótico de la candidiasis vulvovaginal (VVC; con azoles orales o vaginales) dan como resultado fracciones de curación subóptimas y altas tasas de recurrencia. Además, el uso prolongado aumenta la probabilidad de efectos secundarios y resistencia a los medicamentos (1).
Conclusión
Un ecosistema intestinal en equilibrio mantiene unos niveles apropiados de cada microorganismo. El tratamiento natural para la Cándida debe estar enfocado en recuperar este equilibrio microbiológico, tratando la causa que lo desestabilizó (alimentación, estrés, ritmo circadiano…).
Referencia bibliográfica
- Martin Lopez J. E. (2015). Candidiasis (vulvovaginal). BMJ clinical evidence, 2015, 0815.
- Xie, H. Y., Feng, D., Wei, D. M., Mei, L., Chen, H., Wang, X., & Fang, F. (2017). Probiotics for vulvovaginal candidiasis in non-pregnant women. The Cochrane database of systematic reviews, 11(11), CD010496. https://doi.org/10.1002/14651858.CD010496.pub2
- Van de Wijgert, J., & Verwijs, M. C. (2020). Lactobacilli-containing vaginal probiotics to cure or prevent bacterial or fungal vaginal dysbiosis: a systematic review and recommendations for future trial designs. BJOG : an international journal of obstetrics and gynaecology, 127(2), 287–299. https://doi.org/10.1111/1471-0528.15870
- Hanson, L., VandeVusse, L., Jermé, M., Abad, C. L., & Safdar, N. (2016). Probiotics for Treatment and Prevention of Urogenital Infections in Women: A Systematic Review. Journal of midwifery & women’s health, 61(3), 339–355. https://doi.org/10.1111/jmwh.12472